اثر عصاره هیدروالکلی کاکوتی کوهی بر آسیب هاي بیضه اي ناشی از ديابت شیرين در موش هاي صحرايی نر
ناهید بلبل حقیقی )MSc(2، سحر ملزمی )MSc(1*، شهربانو گلی )PhD(9، حمید محمدصادقی) MSc(9، محسن امینیان )MD(۵
2-گروه مامایی، دانشكده پرستاری و مامایی، دانشگاه علوم پزشكی شاهرود
1-گروه علوم آزمایشگاهی، دانشكده علوم پزشكی، دانشگاه آزاد اسلامی، واحد شاهرود
9-مركز تحقیقات علوم رفتاری و اجتماعی در سلامت، دانشكده بهداشت، دانشگاه علوم پزشكی شاهرود
9-گروه فیزیولوژی، دانشكده پزشكی، دانشگاه علوم پزشكی شهید صدوقی یزد
۵-گروه داخلی، دانشكده پزشكی، دانشگاه علوم پزشكی ارتش
خلاصه
سابقه و هدف: با توجه به اینكه دیابت اثر سویی بر پدیده اسپرماتوژنز و باروری مردان دارد و دسترسی آسان و بی خطر به داروهای گیاهی برای درمان عوارض ناشی از دیابت، در این مطالعه دو اثر پیشگیری كننده و درمانی كاكوتی كوهی بر آسیب بیضه ای در موش های صحرایی نر بررسی شد.
مواد و روشها: در این مطالعه تجربی 91 سر موش صحرایی نر نژاد ویستار، با محدوده وزنی 122 تا 112 گرم، به چهار گروه هشت تایی تقسیم گردیدند. گروه شاهد، گروه دیابتی ،كه از طریق تزریق درون صفاقی mg/kg۵۵ استرپتوزوتوسین دیابتی شده، گروه تجربی2، )دیابتی+گاواژ كاكوتی كوهی با دوز mg/kg 222( و گروه تجربی1 )دیابتی + گاواژ كاكوتی كوهی با دوز mg/kg2۵2(، كه پس از دو ماه دیابتی شدن، به مدت پنج هفته عصاره كاكوتی كوهی را به روش گاواژ دریافت كردند. در ابتدای هفته پنجم از نمونه ها خون گیری به عمل آمد و همچنین مقاطع بیضه ها مورد ارزیابی ماكروسكوپی)بیضه راست( )طول، حجم، وزن و قطر بیضه( و هسیتولوژیک )بیضه چپ( )تعداد اسپرماتوژنزیس( قرار گرفت.
یافتهها: در گروه دیابتی كاهش معنیی داری را در سیلول هیای اسیپرماتوگونی)22/1±21/۵2( نسیبت بیه شیاهد) 12/22±22/82( )222/2>p( و كیاهش معنیی دار در سیلولهای سرتولی)28/2±۵۵/۵( گروه دیابتی نسبت به گروه شاهد) ۵8/2±99/28( مشاهده گردید)222/2>p(. همچنین در گروه های تجربی افزایش معنی داری در سیلول هیای اسیپرماتید در گروه تجربی دوم) 22/9±29/229( نسبت به گروه تجربی اول) 92/9±99/222( مشاهده گردید )222/2>p(.
نتیجهگیری: یافته های مطالعه نشان داد كه تجویز دراز مدت كاكوتی كوهی بر قطر و ضخامت مجاری اسپرم ساز بیضه اثر گذار است. لذا ممكن است درمان بیا كیاكوتی كیوهی باعث بهبود در فرایند اسپرماتوژنز مردان دیابتی شود.
واژههای كلیدی: دیابت، انسولین، تستوسترون.
|
گزارش شده است كه شامل كاهش حركت اسپرم، كاهش تعداد اسپرم و افزایش اسپرمهای ناهنجار است )2(. در هند سالانه حدود 31 میلیون دلار صرف هزینة درمان افراد مبتلا به دیابت با ناتوانی جنسی میشود، از آنجا كه ناتوانی جنسی بقاء نسل را تحت الشعاع دارد بر طرف كردن مشكلات آن با كمک داروهای گیاهی كه مورد تایید همگان بوده و حائز اهمیت می باشد )1(. در ایران 9 تا ۵ میلیون جمعیت دیابت دارند )9(. روشهایی كه در حال حاضر برای درمان دیابت غیر وابسته به انسولین استفاده میشوند، مانند تغییر رژیم غذایی و عوامل هیپوگلیسمیک خوراكی، محدودیتهای خاص خود را دارند. كاربرد گیاهان برای درمان دیابت قندی بهطور وسیعی بهویژه دركشورهای آسیای میانه رایج است. سازمان بهداشت جهانی نیز در مورد استفاده از این گیاهان در این كشورها توصیههایی را ارائه |
|
مقدمه دیابت شیرین یک حالت از افزایش قند مزمن است كه علت مهم بیماریهای میكرو و ماكرواسكولار می باشد و تقریبًًا بر تمام سیستم های بدن تاثیر می گذارد. شواهد رو به افزایشی حاكی از افزایش استرس اكسیداتیو در افراد دیابتی به واسطه تولید بیش از حد انواع اكسیژن واكنشی) Reactive Oxygen ROS=Spcies( و كاهش كارایی دفاع های آنتی اكسیدانی وجود دارد. فرایندی كه به صورت ابتدایی شروع می شود و زمینه بیماری را فراهم می كند. در بیماری دیابت، اكسیداسیون لیپیدها، ANA و پروتئینها با گذشت زمان افزایش مییابد . كاهش تستوسترون، تحلیل غدد ضمیمه تولید مثلی، كاهش میل جنسی و رفتارهای جنسی در افراد مبتلا به دیابت گزارش شده است. دیابت هم چنین بر اسپرماتوژنز تأثیر می گذارد. كیفیت پایین مایع سمینال در افراد دیابتی نیز |
© این مقاله حاصل طرح به شماره 991۵ دانشگاه علوم پزشكی شهید صدوقی یزد می باشد.
*مسئول مقاله: سحر ملزمی
آدرس: شاهرود، دانشگاه آزاد اسلامی واحد شاهرود، گروه علوم آزمایشگاهی. تلفن: 91932922-219 E-mail: saharmolzemi@yahoo.com
99
نموده است )9(. بسیاری از گونه های گیاهی، در طب سنتی ملل مختلف بهواسطه خواص كاهنده قند خون برای درمان دیابت قندی مورد استفاده قرار میگیرند .)9(.
كاكوتی كوهی با نام علمی Ziziphora clinopodioides Lam، گیاهی است متعلق به تیره نعناعیان گونه Ziziphora كه بخشهای هوایی آن به صورت ادویه مصرف می گردد. این گیاه در اغلب مناطق ایران می روید و دارای 3 زیر گونه بومی در ایران است)9(.
تمام قسمتهای این گیاه در طب سنتی مورد استفاده دارد. بسیاری از گونههای گیاهی هستند كه در طب سنتی ملل مختلف بهواسطة خواص كاهنده قند خون برای درمان دیابت قندی مورد استفاده قرار میگیرند)۵(.
تاثیر عصاره هیدروالكلی كاكوتی كوهی بر تعداد سلولهای فعال بتای پانكراس در موشهای سوری دیابتی نوع یک ناشی از استرپتوزوتوسین، به نقش آنتی اكسیدانی و كاهنده قند خون این گیاه اشاره كرده اند)۵(. Mahdavi و همكاران گزارش نمودند كه تیمار درون صفاقی عصاره كاكوتی كوهی به مدت 9 هفته، بطور موثری فعالیت آنزیمهای آنتیاكسیدان كبد و كلیه رتهای دیابتیشده توسط استرپتوزوتوسین را افزایش میدهد. این عصاره، مالوندیهیدرات را كه یک ماركر لیپید است، به میزان قابل توجهی در رتهای دیابتی كاهش و نیز ظرفیت آنتیاكسیدان توتال را در طرح غیروابسته به غلظت، افزایش میدهد)۵(. بنابراین ،عصاره كاكوتی كوهی دارای نقش محافظتی بر ضد آسیب اكسیداتیو در رتهای دیابتیشده توسط استرپتوزوتوسین است بدلیل خاصیت آنتی اكسیدان گیاه اثرات مخرب دیابت را در بدن از بین می برد )1(.
Konyalιoglu و همكارانش نشان دادند كه تیمار عصاره آبی كاكوتی كوهی بهمدت 12 روز، موجب اثر آنتیهیپرگلیسمیک وابسته به دوز در رتهای دیابتیشده توسط استرپتوزوتوسین میگردد. یافتههای آنها اثرات مثبت كاكوتی كوهی را بر رتهایی كه توسط استرپتوزوتوسین دچار اختلالاتی در پروفیل لیپوپروتئین، وضعیت آنتیاكسیدان و تحمل گلوكز شده بودند، نشان داد پس ،عصاره آبی كاكوتی كوهی، در كنترل دیابت، اختلال در پروفیل لیپید و استرس اكسیداتیو با فعالنمودن آنزیمهای آنتیاكسیدان پانكراسی مفید است )8(. در نتیجه هدف از انجام این تحقیق بررسی اثر دوزهای مختلف عصاره هیدروالكلی كاكوتی كوهی بر میزان انسولین، گلوكز سرم ،هورمون تستوسترون و آسیبهای بیضه ای ناشی از دیابت ایجاد شده با استرپتوزوتوسین در موشهای صحرایی میباشد.
مواد و روشها
گیاه كاكوتی كوهی )Ziziphora clinopodioides Lam(: در بهار 2939 از روستای ابر شهرستان شاهرود جمعآوری شد و نام علمی این گیاه توسط اساتید بیوسیستماتیک گیاهی دانشگاه آزاد دامغان با كد 2۵822292تایید شده است. پس از تمیز كردن، گیاه در سایه و در فور یا آون 9 درجة سانتیگراد خشک شد. سپس برگ هایخشک شده پودر گردید و )حدود 22 گرم( با 922 میلیلیتر اتانل) 22 درصد( در دستگاه سوكسله بهمدت 81 ساعت قرار گرفت. سپس عصاره ،صاف شد و توسط دستگاه روتاری، خشک گردید.
حیوانات: در این مطالعه 91 سر موش صحرایی نر از نژاد ویستار، با محدوده وزنی 122 تا 112 گرم، انتخاب و به چهارگروه هشت تایی بصورت زیر تقسیم گردیدند. 2-گروه شاهد: شامل هشت سر موش نر كه همزمان با دیابتی شدن سایر گروهها
بمنظور حفظ تعادل بدن بافرسیترات بصورت درون صفاقی با توجه به وزن دریافت كردند.
1-گروه دیابتی: از طریق تزریق درون صفاقی استرپتوزوتوسین )محصول شركت سیگما با كد علمی S0130( با دوزmg/kg ۵۵ دیابتی شده و سنجش قندخون برای القای دیابت ،81 ساعت بعد از تزریق یكبار )STZ=Sterptozotosin( )S0130( و با استفاده از خون سیاهرگ دمی، به كمک دستگاه كلوگوكارد صفر و یک انجام شد و موشهای با قندخون بالاتر از) mg/dl1۵2( دیابتی در نظر گرفته شدند)۵(.
9- گروه تجربی2: پس از گذشت دو ماه از دیابت، كاكوتی كوهی را با دوز mg/kg 222 یكبار در روز بصورت روزانه بصورت گاواژ دریافت كردند.
9- گروه تجربی1: پس از گذشت دو ماه از دیابت، كاكوتی كوهی را با دوز mg/kg 2۵2 یكبار در روز بصورت گاواژ دریافت كردند.
موش ها در قفسهای تمیز با درجة حرارت19–11 درجة سانتیگراد و سیكل نوری 21 ساعت نور ،21 ساعت تاریكی و رطوبت نسبی 12–92 درصد در آزمایشگاه نگهداری شدند .در ابتدای هفته پنجم پس از بیهوشی توسط )كتامین و زایلزین( از نمونهها خونگیری مستقیم از قلب به عمل آمده و فاكتورهای بیوشیمیایی و هورمونی خون و مشاهدات ماكروسكوپی اعم از )وزن، قطر، طول ،حجم بیضه( مورد ارزیابی قرار گرفت و مقاطع بیضه ها برای انجام آزمایشات هسیتولوژیک در فرمالین 22 درصد قرار داده شد و به آزمایشگاه منتقل شد.
بررسی ماكروسكوپی: برای بررسی وزن بیضه از ترازوی با دقت 222/2 گرم استفاده شد. طول و قطر بیضه نیز با استفاده از كولیس و حجم بیضه نیز با كمک استوانه مدرج اندازه گیری شد )2(.
اندازه گیری قطر توبول سمینیفروس: به منظور ثبوت بافت، نمونه های تهیه شده ،به مدت 92 ساعت در محلول فرمالین 22 درصد قرار داده شد. پس از آنكه بافت ثابت گردید، برای قالبگیری آنها در پارافین پاساژ بافت انجام شد. با استفاده از میكروتوم با تیغه ثابت، برشهایی به ضخامت ۵ میكرون به صورت متوالی تهیه گردید. برشها به بن ماری منتقل شده و بر روی لام آغشته به چسب آلبومین قرار داده شد. نمونه ها در دمای معمولی اتاق خشک شده و بعد از گذشت 19 ساعت لام ها آماده رنگ آمیزی بود. در این تحقیق از روش رنگ آمیزی هماتوكسیلین و ائوزین استفاده شد. قطر توبول سمینیفروس با استفاده از روش سینگ اندازه گیری شد .1۵توبول به طور تصادفی در هر برش عرضی بیضه انتخاب و میانگین قطر توبولی با اندازه گیری قطر كوچک و بزرگ هر توبول با استفاده از یک میكرومتر كالیبره شده و متصل به چشمی میكروسكوپ محاسبه گردید و همچنین برای بررسی اسپرماتوژنز در همان تعداد توبول نیز تعداد اسپرماتوسیت های 1و2، اسپرماتید، تعداد دستجات اسپرمی لومینال و ضخامت غشا پایه مورد بررسی قرار گرفته است)1(.
شمارش سلول های سرتولی: 1۵ توبول در هر فیلد و در هر برش عرضیی بیضیه انتخاب و سپس در زیر میكروسكوپ تعیداد سیلول هیای سیرتولی شیمارش شید .میانگین این تعداد برای هر گروه محاسبه گردید)1(. مقایسیه بیافتی در گروههیای مختلف با كمک تست آنالیز واریانس یكطرفه با فرمول زیر انجام شده است:

|
های سلولی توبول سمینیفروس مشاهده شدند. ساختارهای بافتی در گروه دییابتی تخریب شده و كاهش قابل توجه ای در مجموعه های سیلولی مشیاهده گردیید و ساختار های بافتی در گروه درمان با كیاكوتی بیا دوز 2۵2 mg/kg بهبیود معنیی داری یافت )جدول2(. تعداد سلول های اسپرماتوژنیک در گروه دییابتی نسیبت بیه شاهد كاهش داشته و تعداد سلولهای اسپرماتوژنیک در گیروه تجربیی 2 و 1 )كیه وابسته به دوز داروی مصرفی می باشند( نسبت به گروه دیابتی افزایش معنی داری یافته است )2۵/2p<( و همچنین در گروه تجربی 1 كه دوز داروی مصرفی بیشتر از گروه تجربی 2 هست افیزایش معنیی داری در مییزان سیلولهای اسیپرماتوژنز و ضخامت غشا پایه و سلولهای سرتولی مشاهده گردید) شكل 2(. افزایش در ضخامت غشای پایه در گروه دیابتی نسبت به شیاهد دییده شید. همچنین مشخص شد كه آتروفی توبول های سمینیفروس در موشهای صیحرایی دیابتی افزایش شدیدی یافته اما با مصرف كاكوتی كوهی از میزان این آسییب هیا كاسته میشود. كاهش معنی داری در وزن، قطر، طول و حجم بیضیه هیا در گیروه دیابتی نسبت به گروه شاهد مشاهده گردید. همچنین افزایش معنی داری در وزن ،قطر، طول و حجم بیضه ها در گروه تجربی 1 نسیبت بیه گیروه دییابتی مشیاهده گردید)جدول 1(. پس از بررسی آزمایش هورمون ها و سرم خون مشیخص گردیید كیه گیروه دیابتی كاهش معنی داری در میزان تستوسترون، انسولین نسبت بیه گیروه شیاهد داشته است و همچنین افزایش معنی داری در میزان گلوگز خون نسبت بیه شیاهد مشاهده گردید. در گروه تجربی 2و1 نسبت به گروه دیابتی افزایش معنیی داری در میزان انسولین و تستوسترون وجود داشته و در تجربی 1 نسبت به 2 بیا توجیه بیه افزایش دوز داروی مصرفی نیز افیزایش معنیی داری در مییزان انسیولین مشیاهده نگردید و همچنین كاهش معنی داری در مییزان گلیوگز سیرم در گیروه تجربیی1 نسبت به تجربی2 مشاهده گردید )جدول 9(. |
|
|
روش آنالیز هورمون تستوسترون: بخش تستوسترون در سرم با پلاسما با Gamma-B Testesteron kit )محصول شركت زیست شیمی( انجام میگیرد. شیوه RIA با آنتی بادی مضاعف اساس كار این كیت می باشد. در این كیت به ترتیب مقادیر مشخص از نمونه، تسوتسترون نشان دار) T-21۵1( و آنتیسرم تستوسترون به هم افزوده شدند. پس از انكوباسیون درجه حرارت معمولی نمونه انكوبه شده و بعد سانتریفوژ می گردد تا رسوب جدا شود. تعداد جایگاههای اشغال شده آنتی سرم به وسیله تستوسترون نشان دار، با غلظت تستوسترون نمونه رابطه عكس دارد. شمارشگرهای گاما و مقایسه نتایج با سرم های استاندارد، غلظت تستوسترون را مشخص میكند. روش آنالیز هورمون انسولین: بعد از جدا كردن سرم خون از محتویات خونی توسط كیت زیست شیمی انسولین خون مورد سنجش قرار گرفت . روش آنالیز گلوكز خون: بعد از جدا كردن سرم خون از محتویات خونی توسط كیت پارس آزمون، گلوكز خون مورد سنجش قرار گرفت، بمنظور اطمینان از قند خون بالای گروه ها یک روز در میان با دستگاه گلوكوكارد صفر یک از سیاهرگ دمی خونگیری تا پایان طول درمان انجام می شد. تجزیه و تحلیل آماری: محاسبه آماری با استفاده ار نرمافزار آماری نسخه spss21 انجام شد و برای مقایسه میانگین بین گروه ها از آنالیز واریانس یک طرفه و در مواردی كه پاسخ معنی داری دیده شد از پس آزمون توكی برای یافتن جایگاه اختلاف استفاده شد و 2۵/2<p معنی دار در نظر گرفته شد.
یافتهها حیوانات دیابتی به عوارض متعدد ناشی از دیابت، شامل: پرخوری، پر نوشی و اسهال مبتلا شدند. بافت بیضه در گروه شاهد با لایه آلبوژینه پوشییده و مجموعیه |
جدول 2. مقایسه تعداد سلولهای بافتی بیضه در گروه های مختلف مورد بررسی
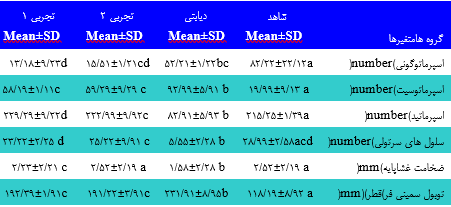
جدول 1. مقایسه تغییرات مورفولوژیک بافت بیضه در گروههای مختلف مورد بررسی كه با دامنه های 2۵/2>p>2/22 ،p و222/2>p در مقایسه با گروه شاهد تعریف گردیده است
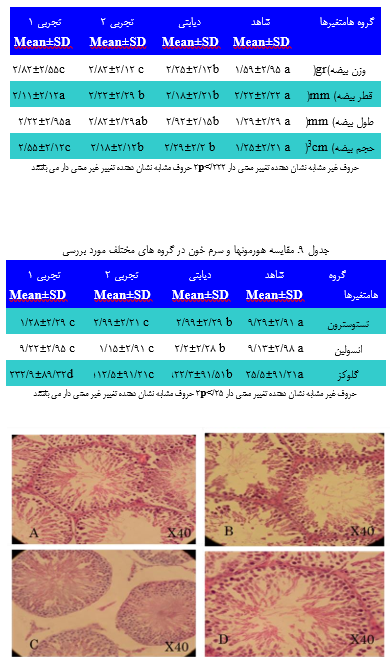
شكل 2. A,B,C,D نشان دهنده لوله های اسپرم ساز با بزرگنمایی X40 هستند.A – لوله اسپرم ساز و سلول سرتولی را در گروه شاهد نشان میدهد. B- چروكیده شدن لوله اسپرم ساز، افزایش فضای بینابینی و كاهش سلول های زایند و سلول های سرتو لی را در گروه دیابتی نشان می دهد .C- افزایش قطر لوله های اسپرم ساز و افزایش سلولهای سرتولی و كاهش چشمگیر فضای بینابینی نسبت به دیابتی را در گروه تجربی 2 و 1 نشان می دهد.
|
می گذارد. این تحقیق دارای نقاط ضعف و قوت نیز می باشید، از نقیاط ضیعف آن میتوان به عدم بررسی و آزمیایش، فعالییت ضید رادیكیال آزاد كیاكوتی كیوهی و همچنین عدم مقایسه این دارو با دیگر آلكلوئیدها، اشاره كرد. نقیاط قیوت نییز بیه تعداد جامعه آماری مناسب و روش گاواژ برای پرداخت دارو نیز اشاره كیرد، چراكیه در روش گاواژ داروها با فاصله زمانی مناسب اعمال اثر در بدن می كنند. در گیروه دییابتی ب دلیل آس یب هیای دیاب ت از جمل ه تولیید رادیك ال آزاد س بب ك اهش پارامترهای سلولهای اسپرم سیاز مییشیود و كیاكوتی كیوهی ایین عیوارض را بیا تحریک اسپرماتوژنر تصحیح میكند. ارتباط منطقی بین تمیامی پارامترهیا گوییای این است كه هرچه دوز دارو افزایش یافت تعداد سلولهای اسپرم ساز به علت وجود مواد آنتی اكسیدانی فراوان افزایش یافت كه این نشان دهنده تاثیر مثبیت دارو بیر آسیب های حاصل از دیابت هست. Ghafari و همكاران نشان دادند كیه تیمیار عصاره هیدروالكلی) ۵2%( میوه كیاكوتی كیوهی موجیب كیاهش گلیوكز سیرم در رتهای تیمار شده توسط آلوكسان میگردد )9(. یک مطالعه برای اولیین بیار اثیر آنتیهیپرگلیسمیک عصاره میوه كاكوتی كیوهی را گیزارش كیرد كیه ییک داروی یونانی مورد استفاده توسط پزشكان یونانی برای درمان دیابت اسیت كیه بیا نتیایج حاصل از تحقیق حاضر نیز همخوانی داشت )29(. كاكوتی كیوهی بیا فعیالنمیودن رسیپتورهای فعیالشیده تكثییر پراكسییزوم )Peroxisome proliferator-activated receptor=PPAR( دارای عمل ضددیابتی است. گالیک اسید موجود در این بخش ازگیاه، تركیب مهیم |
|
بحث و نتیجه گیری در این مطالعه تیمار طولانی مدت عصاره هیدروالكلی) 22%( كاكوتی كیوهی ب ه حیوان ات دی ابتی، موج ب بهب ود آس یبهای بیض ه ای اع م از بررس ی ه ای ماكروسكوپی و میكروسكوپی ناشی از دیابت در مقایسه با موش های دیابتی بدون هیچ تیماری شده است. در این مطالعیه افیزایش معنیی داری در مییزان هورمیون تستوسترون و انسولین در گروه های تجربی نسبت به شاهد مشاهده شد كه علیت این امر را میتوان به تحریک ترشح انسیولین در بیدن توسیط كیاكوتی نسیبت داد )3و2(. بیماری دیابت باعث افزایش استرس اكسیداتیو و ایجاد اكسیژن فعال شیده و منجر به آسیبهای سلولی از طریق پر اكسیداسیون چربیهیا و تخرییب اكسییداتیو پروتئینها و DNA می شوند)22(. ضخامت غشای پایه لوله های اسپرم سیاز نییز نقش مهمی در اسپرماتوژنزیس ایفا می نماید)22(. طیی دیابیت ضیخامت غشیای پایه لوله های اسپرم ساز افزایش یافته، ایین افیزایش، كیاهش تولیید اسیپرم و در نهایت كاهش اندازه توبول اسپرم ساز را به دنبیال خواهید داشیت از طیرف دیگیر ارتباط مثبتی بین قطیر توبیولی و فعالییت اسیپرماتوژنز وجیود دارد )21(. كیاكوتی كوهی باعث عدم فعال شدن پروتئین كیناز –C، كاهش گلیكاسیون پیروتئین هیا ،لیپید ها و در نتیجه تغییرات در فعالیت آنزیم های سلول و افزایش آنتیی اكسییدان ها می شود و از این طریق سبب كاهش اثرات مخرب دیابت بر بافت بیضه گردید. در این تحقیق از دارو با روش گاواژ بیه میدت 9۵ روز بیه موشیها داده شید،كه در روش گاواژ بدلیل فراهم زیستی دیرتر مناسبترین زمان 9۵ روز می باشید و نسیبت به روش تزریق زیر جلدی یا درون صفاقی در بدن مدت طولانی تری اثیر خیود را |
و موثر ایین گییاه اسیت )29(.سیلولهای اسیپرم پسیتانداران دارای مقیادیر بیالای اسیدهای چرب غیراشباع، پلاسمالوژن و اسفنگومیلین است كه سوبستراهای مهیم در عمل اكسیداسیون به شمار میروند )2۵(. در حالت طبیعی، ساز و كارهای آنتیی اكسیدانی در بافتهای تولید مثلی وجیود داشیته و از بیروز آسییبهای اكسییداتیو در سلولهای گنادی و اسپرماتوزوآیی بالغ جلوگیری میكنند كه وجود آنتیاكسیدان ها در كاكوتی كوهی نیز اثرات مضر دیابت را از بیین بیرده و در گیروه هیای تجربیی بهبود بافتی و ماكروسكوپی بیضه مشاهده می شود )28و21(.
در تحقیقی دیگر به اثیرات مهیم كیاكوتی كیوهی اشیاره شید كیه تغیییرات چشمگیر در قطر لوله را در سلولهایІ و II اسیپرم سیاز و مهیار اسیپرماتوژنز در مراحل اسپرماتوسیت توبولهای كوچک حیوانات دیابتی روی می دهد كه در نتایج ما نیز كاهش قطر لوله اسپرم ساز و افزایش قطر غشای پایه در گروه های دیابتی مؤید آن میباشد و با نتیایج حاصیل از ایین پیروژه همخیوانی دارد. همچنیین در گروههای دیابتی تیمار شده به نظر می رسد كاكوتی كیوهی بیا مكانیسیم هیای متعدد منجر به افزایش قطر توبول، كیاهش غشیای پاییه و بهبیود در سیلولهای اسپرماتوژنیک گردیده است )11(. در كل مطالعات میكروسكوپ نیوری حاصیل از این پروژه نشان دادند كه در بیضه های رت دیابتی افزایش ضخامت غشیای پاییه لوله های سمنیفر متعاقب دیابت طی درمان به مدت ۵ هفته با كاكوتی كیوهی بیه طور معنی داری كاهش می یابد. همچنین بیا توجیه بیه نتیایج حاصیل از تحقییق حاضر كاهش در تعداد سلول های سرتولی منجر به كاهش در تعداد اسپرماتوگونی میشود )چراكه وظیفه تغذیه سیلولهای اسیپرم سیاز را بیر عهیده دارد(. سیلولهای سرتولی از طریق تامین حمایت فیزیكی، تغذیه ای و سیگنال های هورمیونی لازم برای اسپرماتوژنز موفق نقش حیاتی در اسپرماتوژنز بازی میكند. بنیابراین هنگیام كاهش تعداد سلولهای سرتولی بیه شیدت از تعیداد سیلول هیای زاینیده كاسیته می شود. در مطالعه حاضر دیابت باعث كاهش تعیداد سیلول هیای سیرتولی و بیه دنبال آن كاهش تعداد سلولهای زاینده گردید.
در این مطالعه مشخص گردید كه دیابت در موش های صیحرایی نیر باعیث اختلال عملكرد بیضه ها گردیده و درمان با كیاكوتی كیوهی از طرییق محافظیت لولههای اسپرم ساز و نیز سلولهای اسپرماتوژنیک این اختلال در عملكرد را بهبیود بخشیده است، در مجموع تمامی آسیب های ناشی از دیابت در گیروه تجربیی دوم )دییییابتی+ كیییاكوتی mg/kg2۵2( بهتیییر از تجربیییی اول )دیابتی+كیییاكوتی mg/kg222( میباشید و بدینوسییله توصییه میی گیردد میردان دییابتی و دارای اخ
تلالات جنسییی از عص اره هیییدروالكلی ك اكوتی كییوهی روزان ه بییه میییزان mg/kg2۵2 مصرف كنند .
تقدیر و تشكر
بدینوسیله از معاونت تحقیقات و فناوری دانشگاه علیوم پزشیكی ییزد و كلییه افرادی كه مار ا در انجام این تحقیق یاری رسانده اند، تقدیر و تشكر می گردد.
The Effect of Hydroalcoholic Extract of Ziziphora Clinopodioides Lam on
Testicular Damage Caused by Diabetes Mellitus in Male Rats
N. Bolbol Haghighi (MSc)1, S. Molzemi (MSc)2, Sh. Goli (PhD)3, H. Mohammad Sadeghi (MSc)4, M. Aminian (MD)5
1.Department of Midwifery, Faculty of Nursing and Midwifery, Shahroud University of Medical Sciences, Shahroud, I.R.Iran
2.Department of Laboratory Sciences, Faculty of Medical Sciences, Islamic Azad University, Shahrood Branch, Shahroud, I.R.Iran
3.Research Center for Social and Behavioral Sciences in Health, Faculty of Public Health, Shahroud University of Medical Sciences, Shahroud, I.R.Iran
4.Department of Physiology, Faculty of Medicine, Shahid Sadoughi University of Medical Sciences, Yazd, I.R.Iran
5.Department of Internal Medicine, Faculty of Medicine, Aja University of Medical Sciences, Tehran, I.R.Iran
![]()
J Babol Univ Med Sci; 19(12); Dec 2017; PP: 43-9
Received: Jun 28th 2017, Revised: Apr 9th 2017, Accepted: Sep 21th .7102
ABSTRACT
BACKGROUND AND OBJECTIVE: Considering that mellitus diabetes has adverse effects on spermatogenesis and male fertility and given the easy and safe access to herbal medicines to treat diabetes complications, this study investigated the preventive and therapeutic effects of ziziphora clinopodioides lam on testicular damage in male rats. METHODS: In this experimental study, 32 male Wistar rats weighing 200 to 220 g were divided into four groups of eight. The control group, the group that became diabetic through intraperitoneal injection of 55 mg/kg streptozotocin, experimental group 1 (diabetic+100 mg/kg ziziphora clinopodioides lam by gavage) and experimental group 2 (diabetic +100 mg/kg ziziphora clinopodioides lam by gavage) that became diabetic after two months, and received ziziphora clinopodioides lam extract by gavage for five weeks. Blood samples were collected at the beginning of the fifth week, and the testes were examined macroscopically (right testis) (length, volume, weight and diameter of testes) and histologically (left testis) (spermatogenesis count).
FINDINGS: In the diabetic group, there was a significant decrease in spermatogonial cells (58.22±6.11) compared with control (78.18±10.20) (p<0.001) and significant decrease was observed in sertoli cells in diabetic group (5.55±0.87), compared to the control group (17.33±1.57) (p<0.001). In addition, a significant increase was observed in spermatid cells in the experimental group 2 (114.83±4.80) compared with the experimental group 1 (100.33±3.38) (p<0.001).
CONCLUSION: The results of the study showed that long-term administration of ziziphora clinopodioides lam is effective in the diameter and thickness of the spermatic ducts. Therefore, treatment with ziziphora clinopodioides lam can improve the spermatogenesis of diabetic men. KEY WORDS: Diabetes, Insulin, Testosterone.
![]()
Bolbol Haghighi N, Molzemi S, Goli Sh, Mohammad Sadeghi H, Aminian M. The Effect of Hydroalcoholic Extract of Ziziphora Clinopodioides Lam on Testicular Damage Caused by Diabetes Mellitus in Male Rats. J Babol Univ Med Sci. 2017;19(12):43-.9
Corresponding author: S. Molzemi (MSc)
Address: Department of Laboratory Sciences, Shahrood Branch, Islamic Azad University, Shahrood, I.R.Iran
Tel: +98 23 32390380 E-mail: saharmolzemi@yahoo.com
93
The Effect of Hydroalcoholic Extract of Ziziphora Clinopodioides Lam…; N. Bolbol Haghighi, et al
References
1.Anbarian F, Fatemi tabatabaei S, Kazeminezhad I, Mohammadian S. Effects of iron oxide nanoparticles and iron ions on reproductive indices of pregnant syrian rats and neuro-behavioral development of newborns. J Babol Univ Med Sci. 2016;18(3): 45-
53[In Persian]
2.Ghorbani Ranjbary A, Ghorbani Ranjbary N, Ghorbani Ranjbary Z, Jouibar N. Effects of intraperitoneal injection of extracts of origanum vulgare on gonadotropin and testosterone hormones in male wistar rats. J Babol Univ Med Sci. 2014;16(4):57-63. [In
Persian]
3.Ghorbani A, Farahani MA, Mohammadi N. Relationship between sleepiness, physical activity and functional outcomes in iranian patients with type II diabetes. Jundishapur J Chronic Dis Care. 2014;3(1):54-60. [In Persian]
4.Ghafari H, Yasa N, Mohammadirad A, Dehghan G, Zamani MJ, Nikfar S, Khorasani R, et al. Protection by Ziziphora clinopoides of acetic acid-induced toxic bowel inflammation through reduction of cellular lipid peroxidation and myeloperoxidase activity. Hum Exp Toxicol. 2006;25(6):325-32.
5.Sadeghi H, Mansourabadi A, Moogooei M, Nahvinejad M. Antimicrobial effects of Ziziphora clinopodioides extracts on Salmonella typhi Vi+ in vitro, in vivo and amp; amp; cell culture. Clinical Biochemistry. 2011;44(13): 326-30.
6.Tian S, Shi Y, Zhou X, Ge L, Upur H. Total polyphenolic (flavonoids) content and antioxidant capacity of different Ziziphora clinopodioides Lam. extracts. Pharmacognosy magazine. 2011;7(25): 65-70.
7.Konyalιoglu S, Ozturk B, Meral G. Comparison of chemical compositions and antioxidant activities of the essential oils of two ziziphora taxa from anatolia. Pharmaceutical Boil. 2006;44(2):121-6.
8.Sadeghi H, Mansourabadi A, Emami s, Nahvinejad M, Moogooei M. The effect of Ziziphora ethanolic extract on active pancreatic beta cells on streptozotocin induced diabetic mice. Iran J Diabete Metabol. 2015;14(6):373-8. [In Persian].
9.International Diabetes Federation (IDF) Diabetes prevalence. Available From:http://www.diabetesatlasorg.
10. Saddichha S. Diagnosis and treatment of chronic insomnia. Ann Indian Acad Neurol 2010;13(2):94-102.
11. Vishnu A, Shankar A, Kalidindi S. Examination of the association between insufficient sleep and cardiovascular disease and diabetes by race/ethnicity. Int J Endocrinol. 2011;2011:789358.
12. Nagai M, Hoshide S, Kario K. Sleep duration as a risk factor for cardiovascular disease-a review of the recent literature. Curr Cardiol Rev. 2010 6(1):54-61.
13.Cho EH, Lee H, Ryu OH, Choi MG, Kim SW. Sleep Disturbances and Glucoregulation in Patients with Type 2 Diabetes. J Korean Med Sci. 2014;29(2):243-7.
14.Luyster FS, Dunbar-Jacob J. Sleep quality and quality of life in adults with type 2 diabetes. Diabetes Educ. 2011;37(3):347-.55
15.Maracy MR, Kheirabadi GR, Fakhari N, Zonnari R. Comparison of night time sleep quality in type 2 diabetics, impaired glucose tolerance cases and non-diabetics. Iran J Endocrinol Metab. 2011;13(2):165-72. [In Persian]
16.Ardani AR, Talaei A, Borhani Moghani M, Nejati R, Sabouri S, Solooti S, et al. Assessment the rules of demographic variables and body mass index in sleep quality among medical students. J Fundamentals Mental Health. 2012;14(2):132-9. [In Persian]
17.Kita T, Yoshioka E, Satoh H, Saijo Y, Kawaharada M, Okada E, et al. Short sleep duration and poor sleep quality increase the risk of diabetes in Japanese workers with no family history of diabetes. Diabetes Care. 2012;35(2):313-.8
18.Magee CA, Kritharides L, Attia J, McElduff P, Banks E. Short and long sleep duration are associated with prevalent cardiovascular disease in Australian adults. J Sleep Res. 2012;21(4):441-.7
19. Cappuccio FP, D'Elia L, Strazzullo P, Miller MA. Quantity and quality of sleep and incidence of type 2 diabetes a systematic review and metaanalysis. Diabetes Care. 2010;33(2): 414-.02
20.Altay B, Cetinkalp S, Doganavsargil B, Hekimgil M, Semerci B. Streptozotocin-induced diabetic effects on spermatogenesis with proliferative cell nuclear antigen immunostaining of adult rat testis. Fertil Steril. 2003;5(50):20-.5
21. Ulmer CS, Bosworth HB, Germain A, ndquist J, Olsen M, Brancu M, et al. Associations between sleep difficulties and risk factors for cardiovascular disease in veterans and active duty military personnel of the Iraq and Afghanistan conflicts. J Behav Med. 2015;38(3):544-.55
22.Huang TH., HYang Q, Harada M, Li GQ, Yamahara J, Roufogalis BD, Li Y. Pomegranate flower extract diminishes cardiac fibrosis in Zucker diabetic fatty rats: modulation of cardiac endothelin-1 and nuclear factor-kappaB pathways. J Cardiovascular Pharmacol. 2015;46(6):856-.26


